 Гарвардские ученые обнаружили, что БАС и СМА возможно лечить одними и теми же препаратами.
Гарвардские ученые обнаружили, что БАС и СМА возможно лечить одними и теми же препаратами.
Исследователи Института стволовых клеток Гарварда открыли соединение, которое защищает поврежденные нейроны у пациентов со спинальной мышечной атрофией (СМА) — самым частым смертельным генетическим заболеванием у детей младше 2 лет.
СМА — это нейродегеративное заболевание, поражающее двигательные нейроны (мотонейроны). Посредством именно этих длинных нервных клеток головной мозг передает команды мышцам, что обеспечивает двигательную активность человека, в том числе ходьбу, глотание, и даже дыхание. У пациентов с более легкими формами СМА отмечается снижение мышечной массы, которое может привести к инвалидности, в то время как более тяжелые формы сопровождаются параличом и завершаются летальным исходом еще до наступления двухлетнего возраста. Один из 50 человек является носителем гена СМА.
В связи с наличием дисфункционального гена многие мотонейроны у пациентов со СМА не способны синтезировать достаточное количество белка выживания двигательных нейронов (SMN). Недостаточность данного белка провоцирует клеточный стресс и в конце концов гибель клетки.
В отличие от других лабораторий, которые искали возможность для репарации («починки») поврежденного гена, гарвардская команда открыла соединение, помогающее стабилизировать белок СМА как в культуре нейронов человека, так и в моделях мышей. Результаты опубликованы в журнале Cell Reports.
— Полученные результаты открывают целый ряд новых способов применения препарата, — утверждает Ли Рубин, ведущий преподаватель Института стволовых клеток Гарварда и ведущий автор исследования.
Как действовали исследователи
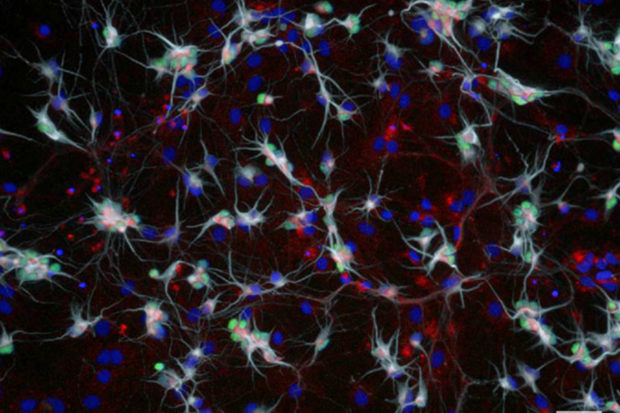
Для создания моделей неврологических заболеваний у человека лаборатория Рубина, которая относится к кафедре стволовых клеток и регенеративной биологии, использует в работе индуцированные плюрипотентные стволовые клетки.
В 2015 году Рубин вывел из индуцированных плюрипотентных стволовых клеток пациентов со СМА несколько типов нейронов с целью определить, почему заболевание поражает преимущественно двигательные нейроны. Он обнаружил, что происходит стрессовая реакция с гибелью клетки, аналогичная той, что происходит при боковом амиотрофическом склерозе (БАС) — нейродегенеративном заболевании, которое проявляется в более позднем возрасте.
Также было выявлено, что несмотря на наличие общей генетической мутации и аналогичных факторов стресса, некоторые двигательные нейроны погибали раньше, а другие — позже.
— Очевидно, что некоторые двигательные нейроны выживали, и поэтому наш следующий вопрос — случайный ли это процесс или этому есть некоторое молекулярное объяснение, — добавил Рубин.
Что заинтересовало ученых
На начальных этапах последнего исследования ученые обнаружили, что некоторые двигательные нейроны в культуре клеток пациентов со СМА синтезировали в четыре раза больше белка выживания двигательных нейронов (SMN), чем соседние клетки. Выживаемость двигательных нейронов с более высоким уровнем упомянутого белка после воздействия токсинов и стрессовых агентов среды была выше.
Анализ культуры двигательных нейронов, полученных от пациентов с БАС, выявил похожие результаты: выживаемость двигательных нейронов с высоким уровнем SMN была выше по сравнению с таковой у остальных клеток. «Мы очень удивились, когда осмотрели контрольную культуру, а также заметили разницу между отдельными нейронами», — отметил Рубин.
— Очевидно, что наличие белка выживания двигательных нейронов крайне важно для выживаемости всех двигательных нейронов, а не только двигательных нейронов из культуры клеток БАС/СМА, — добавила Наталия Родригез-Муэла, сотрудница в лаборатории Рубина и соавтор статьи.
Как может помочь блокировка белков-куллинов
Полученные результаты дают основания полагать, что увеличение количества SMN в любом двигательном нейроне может помочь спасти клетку.
За весь период жизни, клетка постоянно синтезирует и разрушает различные белки. В интересах торможения процесса разрушения SMN исследователи обратили внимание на семейство белков под названием «куллины», которые участвуют в клеточных механизмах разрушения белков.
В 2011 году исследователи лаборатории Рубина доказали участие фермента GSK3b в стабилизации SMN. В процессе деградации практически всех белков с участием фермента GKS3b лежат белки из семейства куллинов. По словам Рубина, исследователи предположили, что блокирование данного куллин-опосредованного механизма может препятствовать разрушению SMN и способствовать сохранению его стабильности.
Исследователи с участием соавтора Нади Литтерман ввели в культуру двигательных нейронов человека и мыши соединение, которое блокирует специфический белок семейства куллин и обнаружили, что воздействие данного соединения сопровождалось повышением стабильности и количества белков выживания двигательных нейронов. В результате соединение обеспечивало выживаемость всех двигательных нейронов, как в культуре клеток человека, так и в модели у мышей.
Кроме того, у мышей со СМА, в том числе с наиболее тяжелыми формами заболевания, отмечалось облегчение течения некоторых симптомов после введения этого соединения.
— Данный процесс указывает на наличие ранее неизвестного терапевтического направления, открытие которого поможет пациентам не только с одним, но и с другим заболеванием, — добавил Рубин.
Управление по разработке технологий Гарварда подало заявку на соответствующий патент.






