 Компания Biohaven завершила набор в третью фазу исследования препарата талдефгробеп альфа для лечения СМА.
Компания Biohaven завершила набор в третью фазу исследования препарата талдефгробеп альфа для лечения СМА.
Биофармацевтическая компания «Biohaven» объявила о завершении набора участников в клиническое исследование RESILIENT, ключевом исследовании фазы 3 применения исследуемого препарата талдефгробеп альфа для лечения спинальной мышечной атрофии (СМА).
Клиническое исследование RESILIENT проводится для проверки эффективности и безопасности талдефгробеп альфа в качестве дополнительной терапии с целью увеличения мышечной массы у пациентов со СМА, получающих в качестве основной стандартную терапию нусинерсеном, рисдипламом или онасемногеном абепарвовек.
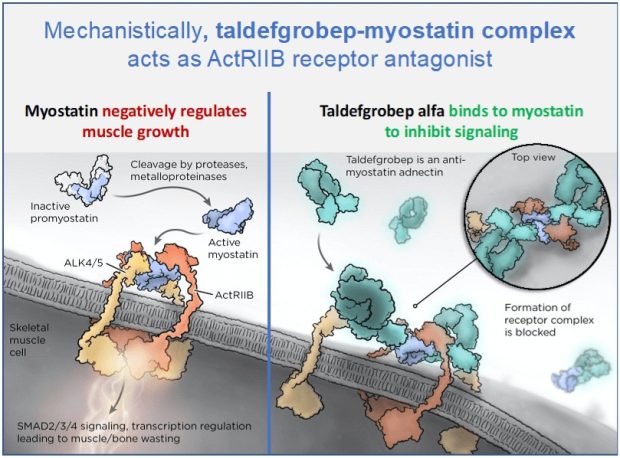
Талдефгробеп альфа — единственный ингибитор миостатина, находящийся в клинической разработке, который нацелен как на миостатин, так и на активин А, два ключевых регулятора мышечной массы и жировой ткани.
Линдси Лэр, д.м.н., вице-президент Biohaven, руководитель клинических разработок программы СМА, заявила: «Мы очень рады завершить набор в эту программу ключевого исследования, поскольку оно приближает нас на один шаг к продвижению новой терапии, нацеленной на мышцы для пациентов со СМА. Несмотря на недавние достижения патогенетическом лечении СМА пациенты по-прежнему испытывают слабость и ухудшение качества жизни, которые можно облегчить путем увеличения мышечной массы и функции, сверх того, что сегодня обеспечивается текущими стандартами лечения».
Справочная информация:
Талдефгробеп альфа— это исследуемый рекомбинантный белок, нацеленный на мышцы, который потенциально может увеличивать мышечную массу и силу у людей, живущих с СМА при использовании в сочетании с другими одобренными методами лечения. Он нацелен на миостатин, природный белок, который ограничивает рост скелетных мышц.
Ингибирование миостатина является потенциальной терапевтической стратегией для детей и взрослых с рядом нервно-мышечных заболеваний, при которых активный миостатин может помочь ограничить рост скелетных мышц, необходимый для достижения основных этапов развития и функционирования.
Талдефгробеп получил статус орфанного препарата в ЕС, а также статус ускоренного режима и статус орфанного препарата от FDA в США.
RESILIENT — это плацебо-контролируемое двойное слепое исследование фазы 3, предназначенное для оценки эффективности и безопасности талдефгробепа по сравнению с плацебо через 48 недель в качестве дополнительной терапии для участников, которые уже постоянно принимают нусинерсен, рисдиплам и/или имеют историю лечения препаратом генной терапии онасемноген абепарвовек.
В этом глобальном исследовании, которое проводится на территории 9 стран оценка проводится среди 180 пациентов-участников. Основная цель – определение безопасности и эффективности талдефгробепа альфа по сравнению с плацебо через 48 недель подкожного введения, что будет определяться по изменению исходного уровня по шкале оценки двигательной функции MFM-32. Дополнительную информацию об исследовании можно найти на SMATrial.com или https://clinicaltrials.gov/study/NCT05337553
Источник Пресс-релиз компании Biohaven






