AveXis подала документы на одобрение препарата генной терапии СМА 1го типа в регистрационных органах США, Европы и Японии.
AveXis подала документы на одобрение препарата генной терапии СМА 1го типа в регистрационных органах США, Европы и Японии.
Компания AveXis, Inc., входящая в корпорацию Novartis и специализирующаяся на клинических испытаниях генной терапии, объявила о подаче заявки в FDA (управление США по санитарному надзору за качеством пищевых продуктов и лекарств), EMA (Европейское агентство лекарственных средств) и в регистрационные органы Японии на одобрение препарата генной терапии AVXS-101, который замещает поврежденный или недостающий ген SMN1 (мутация этого гена является причиной заболевания спинальной мышечной атрофией).
В сегодняшней заявке речь идет о методе внутривенной доставки препарата генной терапии AVXS-101 младенцам со СМА 1-го типа в возрасте до 9 месяцев – эти параметры соответствуют характеристикам группы участников уже состоявшихся клинических испытаний.
Кроме того, в настоящее время AveXis в текущих клинических испытаниях тестирует интратекальную доставку препарата AVXS-101. Такой способ доставки препарата (с помощью инъекции под оболочки спинного мозга между L4 и L5 позвонками) может сделать возможным получение данной терапии пациентами старшего возраста и более крупной комплекции. Как только эти клинические испытания будут завершены, AveXis определит, дадут ли их результаты основания подавать отдельные документы на регистрацию для интратекальной доставки.
Если поданные сейчас документы беспрепятственно пройдут все процедуры утверждения, то в США и в Японии AVXS-101 может быть одобрен уже в первой половине 2019 года, а в Европе – в середине 2019 года.
«Мы поздравляем AveXis и Novartis с достижением этой вехи», — сказал Кеннет Хобби, президент американской ассоциации Cure SMA. — Данные клинических испытаний показывают, что однократная доза препарата генной терапии может радикально изменить течение этого опасного для жизни заболевания. Мы с нетерпением ждем быстрого одобрения FDA, а затем будущих положительных результатов проходящих сейчас клинических испытаний с интратекальным введением препарата».
Начиная с 2010 года, американская ассоциация Cure SMA выдала ряд грантов для Nationwide Children’s Hospital для изучения генной терапии, называемой также перенос генов. СМА вызвана мутацией в гене SMN1. Из-за этой мутации организм человека не производит достаточно белка выживаемости мотонейронов (SMN).
Перенос генов может увеличить уровень SMN-белка с помощью вирус-вектора (в российской науке он называется ретро-вирусом, т.е. оболочка вируса), чтобы доставить ген SMN1 к поврежденным клеткам. В настоящее время изучаются следующие два подхода к решению задачи доставки гена. Первый подход — это инъекция в вену (системная доставка), сейчас этот метод проходит одобрение в FDA, EMAи регистрационных медицинских органах Японии.
Второй способ исследует метод доставки лекарства непосредственно в спинномозговую жидкость (CSF), процесс, известный как КСФ. КСФ- терапия показала многообещающие результаты, при которых возможно снизить количество доставляемого лекарства для взрослых или крупных пациентов. Это может в конечном итоге сделать лечение доступным для более широких слоев населения.
Официальное заявление AveXis см. в приложении.
Уважаемое SMA сообщество,
AveXis, компания Novartis, рада сообщить вам, что мы представили нормативные приложения для AVXS-101 в США, Европе и Японии для использования у младенцев с SMA тип 1. Это важный и захватывающий первый шаг к потенциальному одобрению из AVXS-101, препарата заместительной терапии гена для лечения основной причины SMA.
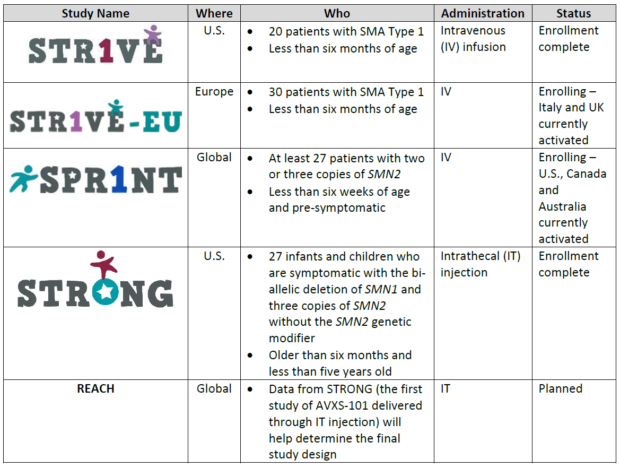
Данные нашего основного исследования фазы 1, проведенного в SMA тип 1, составили основную основу для этих представлений. Основываясь на данных, включенных в приложения, мы ожидаем, что исходная метка будет использоваться для внутривенного (IV) использования AVXS-101 для младенцев с SMA тип 1, поскольку дозировка IV была изучена только в клинических испытаниях у младенцев. Наша программа клинического развития разработана, чтобы помочь нам понять безопасность и то, насколько хорошо AVXS-101 работает в широком наборе педиатрических пациентов с SMA. Например, наше исследование AVXS-101 в SMA тип 2 (STRONG) продолжается, и данные этого исследования помогут определить окончательный проект исследования для запланированного исследования у детей до 18 лет (REACH). Пожалуйста, см. Таблицу ниже из дополнительной информации и обновлений наших запланированных и текущих исследований.
Часто задаваемые вопросы
- Когда AVXS-101 будет одобрен FDA?
- Мы рады представить Биологическую лицензионную заявку (BLA) в Управление по контролю за продуктами и лекарствами США (FDA). FDA примет решение о принятии BLA для рассмотрения в течение следующих 60 дней. Если это будет принято, мы ожидаем, что FDA займёт шесть месяцев, чтобы рассмотреть BLA и принять решение о том, одобрить ли AVXS-101 или нет.
- Это позволяет получить одобрение AVXS-101 в США в первой половине 2019 года. Мы предоставим обновленную информацию о предполагаемом сроке, когда и когда BLA будет принята к рассмотрению.
- Что такое BLA? Что означает, что BLA «принимается»?
- Приложение Biologics License (BLA) — это запрос в FDA для разрешения на продажу биологического продукта в США. Приложение содержит конкретную информацию о продукте, включая доклинические и клинические данные и информацию о производстве.
- FDA сначала проводит поверхностный обзор, чтобы обеспечить полный пакет представления BLA и содержит всю необходимую информацию. В это время они «принимают» файл, и начинается период обзора.
- Если AVXS-101 одобрен FDA, кто будет иметь право на его получение?
- Основное исследование фазы 1 в SMA тип 1 стало основной основой для представления BLA. На основании данных, включенных в приложение, мы ожидаем, что исходная метка будет использоваться для внутривенного использования AVXS-101 для младенцев с SMA тип
- Наша программа клинического развития разработана, чтобы помочь нам понять безопасность и то, насколько хорошо AVXS-101 работает в широком наборе педиатрических пациентов с SMA. См. Таблицу ниже из дополнительной информации и обновлений этих исследований.
- Какое последнее обновление от программы клинического развития?
- AveXis довольна достижениями, которые мы внесли в нашу программу клинических разработок для AVXS-101. Недавно было проведено полное тестирование как испытания 1 фазы STRONG в исследовании SMA тип 2 и Phase 3 STR1VE в типе 1. Кроме того, в Европе было начато исследование фазы 3 STR1VE-EU.
- Более подробную информацию о программе клинического развития см. В таблице ниже.
- Когда будут объявлены обновленные данные клинических испытаний?
- Мы ожидаем наличия надежных данных из нашей программы клинического развития AVXS-101 на ежегодной встрече Американской академии неврологии в начале мая 2019 года, в том числе из исследования STRONG фазы 1 в исследовании SMA тип 2, Phase 3 STR1VE в SMA тип 1, а также как данные нашего исследования предсимптомных пациентов с SMA, известных как SPR1NT.
- Планируете ли вы получить одобрение AVXS-101 в других регионах?
- Да, мы в настоящее время работаем с органами здравоохранения нескольких других стран, чтобы понять их требования к подаче новой заявки на наркотики. Эти органы здравоохранения будут использовать информацию, собранную в наших клинических исследованиях, чтобы определить, может ли AVXS-101 быть одобрен в соответствующей стране
- С кем мне следует связаться, чтобы узнать, может ли мой ребенок пройти клиническое испытание с помощью AVXS-101?
- Для получения дополнительной информации о критериях отбора для наших клинических испытаний, пожалуйста, просмотрите списки на gov или www.studysmanow.com. Вы также можете связаться с нами по адресу medinfo@avexis.com .