 Ждать осталось недолго: вскоре появится генная терапия, раз и навсегда излечивающая это редкое и смертельное нейромышечное заболевание. О весьма позитивных предварительных результатах клинических испытаний фазы I/IIa экспериментальной генной терапии AAVrh74.MHCK7.micro-Dystrophin мышечной дистрофии Дюшенна. На фоне
Ждать осталось недолго: вскоре появится генная терапия, раз и навсегда излечивающая это редкое и смертельное нейромышечное заболевание. О весьма позитивных предварительных результатах клинических испытаний фазы I/IIa экспериментальной генной терапии AAVrh74.MHCK7.micro-Dystrophin мышечной дистрофии Дюшенна. На фоне
известий биржевые котировки компании рванули на 80% вверх, прибавив к ее рыночной стоимости сразу 3 млрд долларов.
- Речь идет о аденовирус-векторной доставке в организм пациентов синтетического трансгена, кодирующего важнейшие домены (экзоны 18–58) белка дистрофина, недостаточность которого является причиной заболевания. Вирусный вектор не способен перенести ген дистрофина, который слишком велик, потому вполне сойдет его усеченный вариант (так называемый микродистрофин), подходящий для назначения 60–70% пациентов.
- Если «Сарепта» докажет, что одна-единственная генотерапевтическая инъекция способна в корне изменить течение миодистрофии Дюшенна, выведя ее фактически к длительной ремиссии, это станет настоящим прорывом. Подвешенным в воздухе остается, впрочем, вопрос со стоимостью подобного лечения, цена которого может доходить до 1–1,5 млн долларов.
Подробности
Трехмесячные результаты генотерапии для первых трех участников (в возрасте 4, 5 и 6 лет) следующие:
- иммуногистохимия показала устойчивую экспрессию трансфектированного микродистрофина, должным образом локализованного в мышечной сарколемме. В среднем экспрессия гена, оцененная долей содержащих микродистрофин мышечных волокон, составила 76,2% от показателя здоровых людей, а средняя его интенсивность — 74,5%;
- вестерн-блоттинг биоптатов мышечных тканей продемонстрировал устойчивый уровень микродистрофина: в сравнении с нормой в среднем 38,2% (по методике «Сарепта») или 53,7% (в соответствии с количественным анализом Общенациональной детской больницы, учитывающим жировую и фиброзную ткани);
- зафиксировано в среднем 1,6 векторных копий на каждое клеточное ядро, что подтверждает наблюдаемый высокий уровень экспрессии микродистрофина: одна векторная копия соответствует приблизительно 50% микродистрофин-содержащих волокон;
- отмечено существенное снижение уровня сывороточной креатинкиназы: в среднем не менее чем на 87%. Этот фермент, ассоциированный с мышечным повреждением, используется в качестве предварительного диагностического показателя миодистрофии Дюшенна;
- серьезных побочных явлений не наблюдалось, если не принимать во внимание повышение гамма-глутаминтрансферазы у двух пациентов (ее рост не достиг троекратного верхнего предела нормы, то есть не является критическим) и тошноту в первую неделю — негативные реакции были купированы увеличенной дозой стероидов.
Подводя итоги, результативность генотерапии AAVrh74.MHCK7.micro-Dystrophin оказалась лучше в четыре раза, нежели минимальный 10-процентный порог, который считается клинически значимым.
Для сравнения: при мышечной дистрофии Беккера, легкой формы дистрофинопатии, приводящей к мышечной слабости и не обязательно параличу, эндогенный синтез дистрофина составляет приблизительно 10% от нормы. Ответ на вопрос, характеризуется ли микродистрофин такими же функциональными свойствами, как нормальный дистрофин, положительный, однако окончательные доказательства данного терапевтического подхода, подтверждающие стабильность или улучшение мышечных способностей пациентов, будут выяснены лишь при долгосрочных наблюдениях.
Следует понимать, что «Сарепта» исследует AAVrh74.MHCK7.micro-Dystrophin на молодых пациентах: в первой когорте возраст участников лежит в диапазоне от трех месяцев до трех лет, во второй — от четырех до семи лет. Другими словами, заболевание испытуемых не столь далеко прогрессировало, чтобы вызвать серьезное разрушение мышечной ткани.
Еще предстоит узнать, сработает ли генотерапия в более старшем возрасте, в том числе среди тех, кто уже прикован к инвалидному креслу. Даже если от последнего избавиться всё же не удастся, мышечная сила пояса верхних конечностей будет существенно подкреплена.
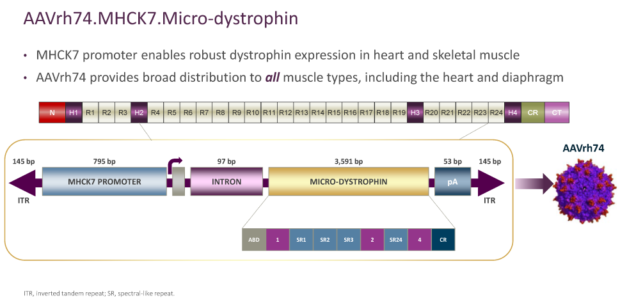
Среди конструктивных особенностей AAVrh74.MHCK7.micro-Dystrophin:
- рекомбинантный аденовирусный вектор AAVrh74 является производным эндогенного серотипа у макак-резус, что наделяет его дополнительной безопасностью: низкой иммуногенностью в сравнении с другими человеческими аденовирусными векторами;
- AAVrh74-вектор системно и надежно доставляется в скелетные, диафрагмальные и сердечные мышцы, даже случайным образом не пересекая гематоэнцефалический барьер;
- использование промотора MHCK7 объясняется желанием добиться повышенной экспрессии микродистрофина в сердечной мускулатуре, поскольку пациенты с миодистрофией Дюшенна обычно умирают по причине пневмонии и/или кардиомиопатии. Доклинические модели показали, что экспрессия микродистрофина в сердце выше до 120%, чем в скелетных мышцах;
- трансген разработан так, чтобы сохранять спектринподобные повторы 2 и 3, которые, есть мнение, важны для поддержания защитных функциональных характеристик дистрофина.
Конкурирующая «Солид байосайенсиз» (Solid Biosciences) сосредоточена на генотерапевтическом SGT-100, который кодирует микродистрофин и испытывается на пациентах в возрасте 4–17 лет. Проблемы с безопасностью экспериментального лечения привели к некоторым задержкам в исследованиях, но сейчас всё наладилось.
Сейчас на рынке представлено единственное лекарство против мышечной дистрофии Дюшенна — «Эксондис 51» (Exondys 51, этеплирсен), но «Сарепта» сориентировала его на ограниченную 13-процентную популяцию пациентов, заболевание которых поддается корректировке путем пропуска экзона 51. Учитывая, что этот антисмысловой морфолинофосфородиамидатный олигонуклеотид (PMO) был одобрен совершенно фантастическим образом: без явных доказательств клинической эффективности по части улучшения моторики и со скромной, менее чем 1-процентной прибавкой уровня дистрофина по вестерн-блоттингу — регулятор, очевидно, выдаст AAVrh74.MHCK7.micro-Dystrophin верительную грамоту без каких-либо проволочек.
На конвейере разработки «Сарепта» находятся и другие PMO-препараты вроде голодирсена (golodirsen) и касимерсена (casimersen), предназначенные для терапии мышечной дистрофии Дюшенна среди пациентов с подтвержденной мутацией гена дистрофина, поддающейся корректировке посредством пропуска экзона 53 и 45 соответственно.
Параллельно изучается иной подход: аденовирусный вектор rAAVrh74.MCK.GALGT2 осуществляет перенос трансгена GALGT2, кодирующего фермент бета-1,4-N-ацетил-D-галактозамин (βGalNAc) гликозилтрансферазу, сверхэкспрессия которого обеспечивает угнетение некорректного функционирования мышечных волокон и нивелирование эффекта дистрофического фенотипа — за счет модифицирования дистрофинассоциированного белкового комплекса (DAPC) и стимулирования атрофина, который весьма гомологичен дистрофину. Подобная суррогатная генотерапия характеризуется определенными преимуществами перед обычным замещением некорректных генов. Во-первых, ее можно применять для лечения различных форм мышечной дистрофии, включая миодистрофию Дюшенна (DMD), дистрофию Лейдена подтипа 2D (LGMD2D), мерозиндефицитную врожденную миодистрофию типа 1A (MDC1A). Во-вторых, она менее иммуногенна в связи с эндогенной экспрессией GALGT2.