 23 декабря Американское Федеральное управление по надзору за качеством пищевых и лекарственных препаратов (FDA) одобрило препарат Спинраза – первое в мире средство для лечения больных спинальной мышечной атрофией (СМА), редкого генетического заболевания, влияющего на мышечную силу и способность двигаться.
23 декабря Американское Федеральное управление по надзору за качеством пищевых и лекарственных препаратов (FDA) одобрило препарат Спинраза – первое в мире средство для лечения больных спинальной мышечной атрофией (СМА), редкого генетического заболевания, влияющего на мышечную силу и способность двигаться.
Препарат Спинраза выпущен в дозировке 12 мг на 5 мл для интратекального введения (непосредственно в спинномозговую жидкость) и одобрен для всех возрастов и типов СМА без каких-либо ограничений.
В настоящий момент препарат Спинраза находится на рассмотрении в Европейском Медицинском Агентстве (ЕМА), решение от которого ожидается в конце первого квартала 2017 года. После получения одобрения от обоих медицинских агенств FDA и ЕМА, для того, чтобы российские пациенты смогли получить доступ к лечению — необходима будет регистрация препарата на территории России.
Несмотря на это, мы перевели на русский полную инструкцию к препарату Спинраза, для того, чтобы все интересующиеся могли получить ответы на ряд вопросов, связанных с препаратом уже сейчас.
Также вы можете ознакомиться с информацией, которую компания Биоген запрашивает у американских пациентов и врачей, для того, чтобы они могли начать лечение Спинразой (т.н. «стартовая форма»).
Скачать: Стартовая форма для пациентов из США
Основная информация из инструкции к препарату Спинраза:
СПИНРАЗА (Нусинерсен) раствор для инъекций 12 мг/5 мл в ампуле на одну дозу
ПОКАЗАНИЯ К ПРИМЕНЕНИЮ
Спинраза – антисмысловой олигонуклеотид, воздействующий на ген выживаемости мотонейронов-2 (SMN2), предназначенный для лечения спинальной мышечной атрофии (СМА) у детей и взрослых.
ПРОТИВОПОКАЗАНИЯ
Отсутствуют
Использование при беременности и кормлении грудью
Достаточные данные о рисках при приеме Спинразы беременными женщинами отсутствуют. В исследованиях на животных никаких нежелательных эффектов для развития эмбриона и плода не наблюдалось.
Данные о проникновении нузинерсена в человеческое молоко, по влиянию препарата на ребенка при кормлении грудью или на выработку молока отсутствуют.
ДОЗИРОВКА И ВВЕДЕНИЕ
Спинраза вводится интратекально (болюсной инъекцией в течение от 1 до 3 минут с использованием иглы для спинальной анестезии). При необходимости используется наркоз, а также ультразвук для контроля введения.
Дозировка: 12 мг (5 мл) на одно введение;
Лечение начинается с 4 насыщающих доз; первые три насыщающие дозы вводятся с интервалом 14 дней; 4я насыщающая доза вводится через 30 дней после 3ей дозы; далее вводятся поддерживающие дозы по одной каждые 4 месяца.
До начала лечения и перед введением каждой дозы Спинразы проводятся следующие анализы:
* Уровень тромбоцитов;
* Протромбиновое время; время образования и активности тромбопластина;
* Разовый количественный анализ белка в моче.
ПОБОЧНЫЕ ЭФФЕКТЫ
После введения сходных препаратов (некоторых антисмысловых олигонуклеотидов) наблюдались:
* нарушения свертываемости крови и тромбоцитопения, то есть повышенный риск кровотечений;
* нефротоксичность, то есть повышенный риск повреждения почек.
Наиболее распространенные побочные эффекты Спинразы включают инфекции верхних и нижних дыхательных путей, полное или частичное спадение легкого или доли легкого, запор, головные боли, боли в спине и постпункционный синдром. Данные побочные эффекты наблюдались и в плацебо-группе, но у пациентов, получавших Спинразу, они наблюдались несколько чаще.
У некоторых пациентов, получавших Спинразу, отмечались случаи сыпи.
КЛИНИЧЕСКИЕ ИССЛЕДОВАНИЯ
Эффективность Спинразы была продемонстрирована в двойном слепом плацебо-контролируемом клиническом исследовании на пациентах младенческого возраста со СМА с клиническими проявлениями. Эффективность Спинразы также подтвердили открытые клинические исследования на группах пациентов со СМА до клинических симптомов, а также с клиническими проявлениями.
Промежуточный анализ показал улучшение двигательных навыков у большей доли пациентов, получавших препарат, чем среди получавших плацебо.
Некоторые пациенты приобрели двигательные навыки, такие как способность сидеть без поддержки, стоять или ходить при том, что без лечения это было маловероятно, а также остались в живых и достигли возраста, достижение которого было маловероятно.
УСЛОВИЯ ХРАНЕНИЯ И ТРАНСПОРТИРОВКИ
Хранить в холодильнике. Допускается хранение вне холодильника в оригинальной упаковке в течение не более 14 дней при температуре не выше 30°C.
Источник https://f-sma.ru/239.html
17 января 2017 года Biogen объявил, что первый пациент получил дозу Commerical SPINRAZA. Это событие знаменует начало ключевого этапа, для дальнейшего лечения как можно большего числа пациентов, получения доступа к SPINRAZA. https://www.spinraza.com/ Мы счастливы от того что пациенты теперь получает реальный коммерческий доступ к первой в мире утвержденной терапии для SMA, проводим большую работу обеспечение широко доступного лечения как можно быстрее.
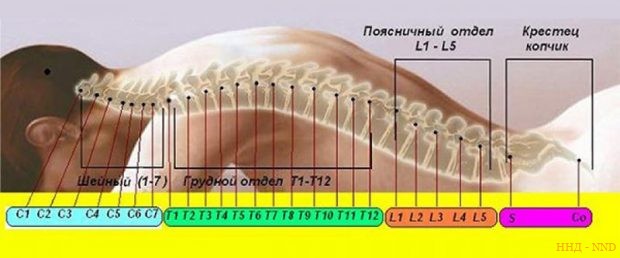
SPINRAZA вводят интратекально
Интратекальное введение – введение лекарственного вещества под оболочки мозга (субарахноидально или эпидурально). Выполняют путем инъекции вещества на уровне L4-L5 поясничных позвонков. При этом игла прокалывает кожу, гиподерму, межостистые и желтые связки отростков позвонков и подходит к оболочкам мозга.
Ссылки по теме: https://www.spinraza.com/