Zolgensma от Novartis присоединяется к растущему списку лекарств, утративших статус ускоренной оценки и одобрения для стран в Европейского Союза.
Zolgensma от Novartis присоединяется к растущему списку лекарств, утративших статус ускоренной оценки и одобрения для стран в Европейского Союза.
Комитет по лекарственным препаратам для человека (EMA’s Committee for Medicinal Products for Human Use (CHMP)), объявил о своем решении удалить генную терапию спинальной мышечной атрофии Zolgensma из программы ускоренной оценки.
CHMP не обнародовал обоснование своего решения, которое фактически означает, что лечение Zolgensma, одобренное в США и запущенное по цене более 2 миллионов долларов США, будет рассмотрено в ЕС через 210 дней, а не в ускоренном порядке за 150 дней. Novartis подтвердил, что его генная терапия в настоящее время находится под стандартным одобрением.
Представитель Novartis объяснил Фокус: «Это даст время агентству CHMP, необходимое для рассмотрения большего объема данных, мы готовы ответить на их вопросы». Представитель AveXis (Novartis приобрела AveXis) также сказал, что они тесно сотрудничают с европейскими регулирующими органами и ожидают «потенциального одобрения Zolgensma в 4 квартале 2019 года».
Позиция CHMP понятна, агентство обязано исключить риски нового лекарства. Но решение CHMP исключить Zolgensma из ускоренной оценки не всегда является отрицательным признаком. Например, Vitrakvi Байер (larotrectinib), который тоже был изъят из программы ускоренной оценки в июне, затем выиграл рекомендацию для условного утверждения в июле.
Так же было с двумя другими препаратами, которые потеряли свои ускоренные обзоры. Это, были лекарство TaiMed Biologics от ВИЧ ibalizumab, которое было одобрено FDA в марте 2018 года как Trogarzo и утратило статус ускоренной оценки в ЕС в июне, а также лекарственное средство AMMTeK для лечения диабета у новорожденных Amglidia (glibenclamide), который по требованию заявителя был переведен через 90 дней на стандартную проверку и позднее, и вскоре был рекомендован CHMP для получения разрешения на применение и продажу в феврале 2018 года.
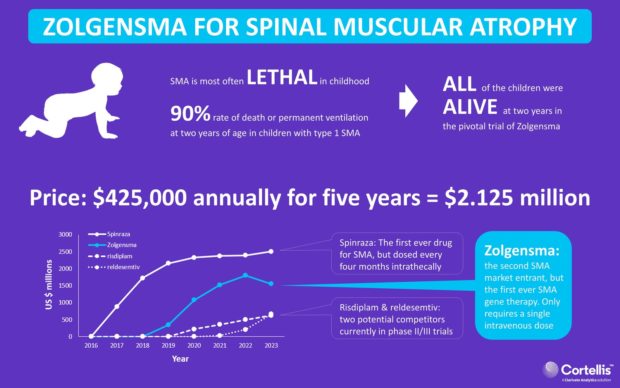
Ситуация с возможной задержкой одобрения и выхода на Европейский рынок единственной генной терапии спинальной мышечной атрофии Zolgensma от Novartis, беспокоит всех людей с СМА живущих в ЕС. Так как для лучшего результата и минимизации последствий СМА, лечение Zolgensma необходимо начинать как возможно раньше. Для многих СМАшек важен каждый месяц, и даже каждый день.
На сегодняшний день единственным в Европе, одобренным CHMP препаратом, замедляющим течение СМА, является Spinraza от компании Biogen. Задержка с одобрением Zolgensma, прямым конкурентом Spinraza, из-за отсутствия альтернативы, увеличит продажи Spinraza на ближайшие несколько месяцев, принося многомиллионные прибыли.