Ведущая компания по исследованиям и разработке в генной терапии AveXis, объявила об успешном завершении низко-дозированных испытаний, первой в мире генной терапии человека для лечения детей с СМА (спинальная мышечная атрофия), препаратом Olesoxime. Тестирование началось в апреле 2014 года.
Ведущая компания по исследованиям и разработке в генной терапии AveXis, объявила об успешном завершении низко-дозированных испытаний, первой в мире генной терапии человека для лечения детей с СМА (спинальная мышечная атрофия), препаратом Olesoxime. Тестирование началось в апреле 2014 года.
«История с переносом генов терапевтическим способом началась 13 мая 2014 года, когда ребенку был успешно введено около 400 триллионов вирусных частиц, содержащих трансген SMN, при этом не возникло осложнений за прошедшее время по сегодняшний день (21 октября 2014 года).
После этого исторического момента для исследования и лечения СМА, последовали инъекции ещё двум младенцам в пониженной дозировке — прокомментировал John A. Carbona, главный исполнительный директор компании AveXis.
AveXis также объявил текущих планах изменить текущий пробный формат тестирования путем добавления третьей группы с применением препарата в средней промежуточной дозировке. Это знаменует собой отход от изначально спроектированной 2-фазы испытаний.
«Мы также на пути, чтобы начать наше интратекальное испытание в первой половине 2015 года, и очень серьезные мысли уделяется переходу к испытаниям для лечения 2 типа пациентов в 2015 году. Прямо сейчас, мы начинаем набор пациентов в качестве подопытных стробирования — сказал Allan Kaspar, главный научный сотрудник AveXis.

AveXis также работает с ведущими исследовательскими центрами в Европе. С целью найти финансовые и правовые аспекты для способов скорейшего инициирования запуска параллельных испытаний применения вирусных частиц содержащих трансген SMN в Европе уже 2015 году.
AveXis также заявил, что в США управление по надзору за продуктами и лекарствами (FDA) выдало статус-обозначение (сиротского) лекарству Olesoxime и схожей по компонентам продукции.
Обозначение (Сиротского — редкого) предоставляется FDA управлением по надзору за продуктами и лекарствами, предназначенных для лечения редких заболеваний или состояний, подверженных менее 200000 человек в США.
Всего насчитывается приблизительно от 25000 до 50000 СМА пациентов в США, Европе и Японии. Обозначение (Сиротского — редкого) для способствует проведению процедуры тестирования лекарственного средства в более короткие сроки. Позволяет привлекать спонсоров, предполагает различные стимулы, в том числе налоговых кредитов для квалифицированного клинического тестирования.
Перевод https://nnd.name/
https://ricercasma.famigliesma.org/
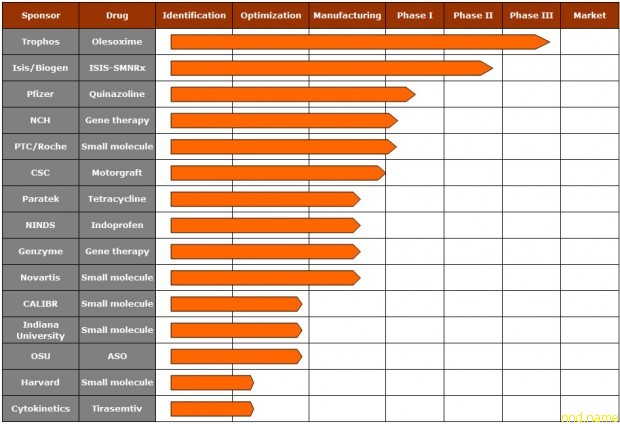
Сейчас есть пять потенциальных лекарств против SMA вошедших в стадию клинических испытаний.